Il nuovo iter di valutazione delle sperimentazioni cliniche introdotto dal Regolamento 536/2014 ha imposto una profonda riorganizzazione dei comitati etici (CE) sul territorio italiano.
La vecchia procedura, che contemplava l’emissione di un parere unico da parte di un comitato coordinatore e successiva e formale accettazione/rifiuto di tale parere da parte di tutti gli altri CE coinvolti, non avrebbe infatti permesso di rispettare le tempistiche ristrette della nuova normativa. Il vecchio iter, inoltre, era caratterizzato da una reiterazione dei processi che sarebbe andata contro gli stessi principi ispiratori del Regolamento.
Il primo passo verso la riorganizzazione è stato sancito con la Legge 3/20181, che ha fissato in 43 i comitati etici da mantenere in Italia, 3 nazionali e 40 territoriali. Pochi mesi dopo, un apposito decreto del Ministero della Salute ha sancito la nascita del Centro Nazionale di Coordinamento dei Comitati Etici2, un organo con funzioni di Coordinamento, indirizzo e monitoraggio che per lungo tempo è stato un re senza regno, visto che ad oggi i 40 CE territoriali non sono di fatto attivi.
I comitati etici nazionali
È stato necessario aspettare ancora un paio d’anni per la costituzione dei CE a valenza Nazionale3; uno, con sede presso l’Istituto Superiore di Sanità ed entrato in funzione quasi subito, ha il compito di valutare le richieste provenienti da istituti pubblici di ricerca, come ad esempio il CNR - Consiglio Nazionale delle Ricerche. Gli altri due, con sede presso AIFA e formalmente attivi solo dallo scorso gennaio, valuteranno rispettivamente le richieste relative a studi in ambito pediatrico e con terapie avanzate.
Nonostante la formalizzazione dei comitati a valenza nazionale, per lungo tempo molte domande sono rimaste senza risposta. Cosa avrebbero valutato questi comitati? Solo studi interventistici con farmaco e dispositivo o anche studi osservazionali? Quali sarebbero stati i limiti di competenza tra comitati nazionali e territoriali? Chi avrebbe valutato gli studi differenti da quelli interventistici con farmaco e dispositivo, visto che solo questi pareva sarebbero stati gli ambiti di competenza dei CE territoriali? E la valutazione delle richieste di fine vita?
Mesi di domande senza risposte finché, in pieno clima Sanremese, la svolta: il 7 febbraio vengono pubblicati i tanto attesi decreti attuativi della legger 3/2018 4,5,6,7.
I comitati etici territoriali
Due 4,7dei 4 sopracitati decreti hanno chiarito quali saranno i compiti ed il funzionamento dei CE territoriali, ed hanno stabilito – dopo lunghe e dibattute analisi rispetto alle performance passate – quali sarebbero stati i 40 CE.
Abbandonata l’idea della valutazione delle richieste di fine vita, che avrebbe richiesto un expertise troppo delicata e l’integrazione di nuove figure professionali, ai comitati territoriali è stata affidata la valutazione di 3 tipologie di studi: interventistici con farmaco, interventistici con dispositivo e osservazionali farmacologici. Ovviamente senza andare a sfociare negli ambiti di competenza dei CE nazionali; ciò significa, pertanto, che i Comitati Territoriali non valuteranno mai studi in ambito pediatrico o che contemplino l’uso di terapia avanzata.
Il promotore dovrà scegliere un unico comitato etico territoriale che esprima un parere valevole a livello nazionale, indipendentemente dal numero e dalla localizzazione dei centri coinvolti; la scelta, che nel caso di studi interventistici con farmaco potrà essere demandata ad AIFA, dovrà essere effettuata in modo che il CE scelto sia indipendente rispetto ai centri clinici in cui si svolgerà la sperimentazione.
Sempre nell’ottica di garantire una elevata trasparenza, la nomina dei componenti dei CE territoriali spetterà non più ai Direttori Generali ma alle Regioni, che avranno 120 giorni di tempo (a partire dall’entrata in vigore del decreto) per procedere con le nomine e istituire i comitati.
Poche le novità, rispetto al passato, in merito alle figure di minima che dovranno essere presenti in questi CE e alle modalità di funzionamento. I componenti, che percepiranno un gettone pari a 300 euro a seduta più eventuali rimborsi spese 6, potranno restare in carica per massimo due mandati e non potranno far parte contemporaneamente di più di un CE.
Ancora valida al possibilità, in casi particolari, di affidarsi anche alla consulenza di professionisti esterni al CE; in questo caso la valutazione dovrà essere effettuata a titolo gratuito e il consulente dovrebbe essere scelto da appositi elenchi/albi costituiti dalle regioni.
Valutazione di altre tipologie di studi
A chi spetterà la valutazione delle altre tipologie di studio che esulano dalle competenze dei CE nazionali e territoriali (es: osservazionali non farmacologici, richieste di usa compassionevole, studi biologici)? Anche in questo caso, parola alle Regioni che potranno decidere se affidare tali competenze agli stessi CE territoriali o se mantenere dei comitati accessori, definiti locali (Figura 1).
Figura 1: futura organizzazione dei comitati etici sul territorio
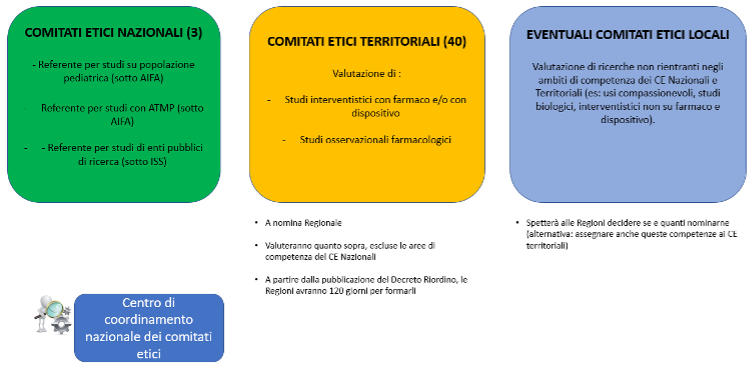
L’iter regolatorio, pertanto, potrebbe differire leggermente tra le diverse regioni.
Aree grigie
Dubbi risolti? Non tutti. Il primo riguarda gli studi osservazionali farmacologici retrospettivi, che a differenza di quelli prospettici non potrà beneficiare (per lo meno da quanto sembrerebbe leggendo l’apposito decreto 8) di un unico parere a livello nazionale. Oltre alla opinabilità di tale scelta, resta poco chiaro chi si prenderà carico della valutazione di tali studi, specialmente qualora dovessero ricadere negli ambiti di competenza dei due CE nazionali sotto egida AIFA.
Stesse perplessità in merito agli studi che non siano osservazionali farmacologici né interventistici su farmaco o dispositivo; anche in questo caso pare si manterrà una valutazione da parte di multipli comitati e a questo punto potrebbe trattarsi di un mix tra CE territoriali e locali.
Delicata sarà anche la fase di transizione, durante la quale eventuali emendamenti a studi ancora in corso secondo Direttiva 2001/20/CE potranno beneficiare di un unico parere nazionale espresso dal vecchio CE coordinatore o da uno dei neonati CE territoriali a seconda dello stato di avanzamento di riorganizzazione in tal senso.
Come ci si dovrà comportare in tutti questi casi? Ai posteri (o alle prossime Q&A dell’autorità competente) l’ardua sentenza.
Grossi interrogativi permangono anche in merito alla sostenibilità finanziaria del sistema. Nonostante le tariffe, standard a livello nazionale per gli studi interventistici con farmaco, siano maggiorate rispetto al passato, la valutazione di un unico comitato per ciascuna sperimentazione non garantirà di certo un flusso in entrata costante ed eterogeneo su tutto il territorio. Problemi ancora maggiori per le regioni che decideranno di mantenere anche dei CE locali, che con ogni probabilità valuteranno soprattutto studi no profit, quindi senza fee di valutazione.
Riferimenti bibliografici
1 LEGGE 11 gennaio 2018, n. 3 Delega al Governo in materia di sperimentazione clinica di medicinali nonche' disposizioni per il riordino delle professioni sanitarie e per la dirigenza sanitaria del Ministero della salute. (18G00019)
2 DM 19 aprile 2018 “Costituzione del Centro di coordinamento nazionale dei comitati etici territoriali per le sperimentazioni cliniche sui medicinali per uso umano e sui dispositivi medici, ai sensi dell’articolo 2, comma 1, della legge 11 gennaio 2018, n. 3”
3 DM 01 febbraio 2022 “Costituzione del Centro di coordinamento nazionale dei comitati etici territoriali per le sperimentazioni cliniche sui medicinali per uso umano e sui dispositivi medici, ai sensi dell’articolo 2, comma 1, della legge 11 gennaio 2018, n. 3”
4 DM 26 gennaio 2023 Individuazione di quaranta comitati etici territoriali
5 DM 27 gennaio 2023 Regolamentazione della fase transitoria ai sensi dell'articolo 2, comma 15, della legge 11 gennaio 2018, n. 3, in relazione alle attivita' di valutazione e alle modalita' di interazione tra il Centro di coordinamento, i comitati etici territoriali, i comitati etici a valenza nazionale e l'Agenzia italiana del farmaco
6 DM 30 gennaio 2023 Determinazione della tariffa unica per le sperimentazioni cliniche, del gettone di presenza e del rimborso spese per la partecipazione alle riunioni del Centro di coordinamento nazionale dei comitati etici territoriali per le sperimentazioni cliniche sui medicinali per uso umano e sui dispositivi medici, dei comitati etici territoriali e dei comitati etici a valenza nazionale
7 DM 30 gennaio 2023 Definizione dei criteri per la composizione e il funzionamento dei comitati etici territoriali
8 DM 30 novembre 2021 Misure volte a facilitare e sostenere la realizzazione degli studi clinici di medicinali senza scopo di lucro e degli studi osservazionali e a disciplinare la cessione di dati e risultati di sperimentazioni senza scopo di lucro a fini registrativi, ai sensi dell'art. 1, comma 1, lettera c), del decreto legislativo 14 maggio 2019, n. 52.